Buchstabe N
Nanofiltration bis Nitrite
Nanofiltration ist ein druckgetriebenes Membranverfahren, das Partikel wie z.B. ein- oder zweiwertige Schwermetall-Ionen, im Nanometer-Bereich zurückhält. Die Nanofiltration mit einer Filterfeinheit von 0,01 bis 0,001 µm wurde in ihren Anfängen als Vorreinigungsstufe in ↗ Umkehrosmoseanlagen eingesetzt deren Filterfeinheit ca. 0,0001µm beträgt. Eine Membranfiltration mit einer etwas gröberen Porengröße zwischen 0,1 bis 0,01 µm wird normalerweise ↗ Ultrafiltration genannt. Wenn Partikel in Größenordnungen zwischen 0,5 bis 0,1 µm abgetrennt werden, spricht man gewöhnlich von ↗ Mikrofiltration. Zum Zurückhalten aller gelösten Stoffe wäre also das der Nanofiltration nachgeschaltete Filterverfahren der Umkehrosmose erforderlich. Die bei der Nanofiltration zum Einsatz kommenden Membranen sind oft nur eingeschränkt temperatur- oder chemikalienbeständig.
Natrium: Natrium ist ein weiches, silberweißes, an feuchter Luft sofort oxidierendes Leichtmetall, aus dem bei Kontakt mit Wasser Wasserstoff und Natronlauge entsteht. Dieser für den Menschen lebenswichtige Mineralstoff ist als anorganische Verbindung im Kochsalz enthalten. Natrium ist wichtig für den Austausch von Wasser zwischen den Zellen und dem Interzellularen Medium. Es ist außerdem für das Arbeiten der Muskeln, insbesondere deren Kontraktion wichtig. Natrium wird im Körper hauptsächlich zur Erzeugung bioelektrischer Potentiale, zur Reizweiterleitung im Nerven und zur Blutdruckregulation benötigt. Als Gegenspieler von Kalium bringt Natrium bildhaft gesprochen Strom auf die Leitung. Das Elemnt Natrium ist für alle tierischen Organismen essentiell und im tierischen Organismus – zusammen mit Chlor – das neunthäufigste Element. Natrium stellt – nach Calcium und Kalium – das dritthäufigste anorganische Ion womit es physiologisch zu den Mengenelementen zählt. In Lebewesen liegt Natrium in der Form von Na+-Ionen vor. (zwei Drittel als NaCl und ein Drittel als NaHCO3) Da Natrium im menschlichen Körper ca. 90 % der extrazellulären Elektrolyte ausmacht, bestimmt die Natriumkonzentration über das Gefäßvolumen und das Volumen der interstitiellen Flüssigkeit. Im menschlichen Körper sind bei einem durchschnittlichen Körpergewicht von 70 kg etwa 100 g Natrium als Na+-Ionen enthalten. (2/3 als NaCl und 1/3 als NaHCO3)
Nickel ist ein silbrig-weißes Metall, das wegen seiner Dichte von 8,9 g/cm3 zu den Schwermetallen zählt. Nickel gelangt oft aus Wasserhahnarmaturen in das Trinkwasser wenn bei der „Verchromung“ von Armaturen eine Mehrschichtgalvanisierung vorgenommen wurde. Dabei wird die Armatur in 3 Schritten mit Kupfer, Nickel und schließlich mit Chrom überzogen. In der Inneren wasserführenden Schicht der Armatur befindet sich oft nur eine Nickelschicht, die zu einer Belastung insbesondere des Stagnationswassers führen kann. Nickel ist ein giftiges Schwermetall und zählt zu den unerwünschten Trinkwasserbegleitstoffen.
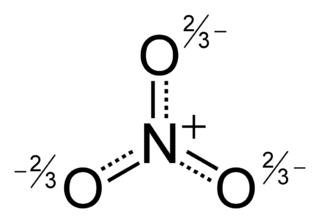
Mesomeriestabilisiertes Nitrat-Anion. (Gesamtladung: –1)
Nitrate
sind in der Bio- und Hydrosphäre allgegenwärtige Salze und
Ester der Salpetersäure die mit Ausnahme des Bismutoxidnitrat BiONO3
gut wasserlöslich sind und eine wichtige Rolle als Nährstoff für
Pflanzen spielen. Sie gehören zu den Hauptnährstoffen im Boden.
Nitrate kommen u. a. in Grünpflanzen vor. Grenzen zur Toxizität
für Säugetiere und Menschen liegen im zweistelligen Grammbereich.
Große Mengen führen jedoch – wie bei allen Salzen – zu osmotischen
Problemen (siehe: Osmoregulation und ↗
Osmose). Im Boden und in Gewässern werden Nitrate durch bakterielle
Nitrifikation gebildet. Bei der Zersetzung wird zuerst Ammonium
freigesetzt. Eine durch Bakterien der Gattung Nitrosomonas verursachte
Oxidation führt zu Nitrit. Nitrit wird durch Bakterien der Gattung
Nitrobacter zum Nitrat weiteroxidiert. Bei einem Mangel an Sauerstoff
entsteht durcvh die bakterielle Denitrifikation von Nitrat jedoch
Stickstoff. Diese Umsetzungen nutzen Kläranlagen um Stickstoffverbindungen
zu beseitigen. Problematisch können hohe Nitratgehalte in pflanzlichen
Nahrungsmitteln aus überdüngten Kulturen sein, da sich diese im
Verdauungsbereich des menschlichen Körpers zu Nitriten umwandeln
können und diese die krebsverdächtigen Nitrosamine bilden. Nitrate
finden sich auch in stickstoffhaltigen Düngemitteln und können so
bei unsachgemäßer Anwendung in der Landwirtschaft mit dem Niederschlagswasser
ins Grundwasser bzw. in Oberflächengewässer gelangen und die Nitratbelastung
erhöhen. Zuviel Nitrat im Trinkwasser kann für Säuglinge wegen der
teilweisen Umwandlung in Nitrit gefährlich werden. Nitrit kann bei
Babys Blausucht verursachen. Zudem können sich, auch bei Erwachsenen,
im Magen Nitrosamine bilden. Nitrosamine sind die krebserregendsten
Stoffe, die man kennt. Hohe Konzentrationen in Gewässern hängen
damit zusammen dass der Mensch schon seit langem in den Stickstoffkreislauf
eingreift, indem er durch Überdüngung, durch Abwässer, durch Stickoxid-Emissionen
und durch Massentierhaltung zusätzlich Stickstoff einträgt. Das
Auftreten von Nitrat im Grundwasser ist hauptsächlich eine Folge
der Düngung landwirtschaftlich genutzter Flächen, vor allen Dingen
in Wein- und Gemüseanbaugebieten. Die Entfernung überhöhter Nitratgehalte
bei der Aufbereitung großer Wassermengen bereitet große Probleme.
Als Lebensmittelzusatzstoff wird Natrium als Natriumnitrat (E 251)
und Kaliumnitrat (E 252) als Konservierungsmittel z. B. zum Pökeln
von Fleisch- und Wurstwaren verwendet, da es die Bildung anaerober
Keime hemmt. Toxikologische Bedeutung: Bei Toxizität von Nitrat
unterscheidet man drei Gruppen:
---------------------
a) Primärtoxizität: Aufnahme großer Mengen Nitrat durch den Menschen.
Symptome: Reizung der Schleimhäute, Übelkeit, Erbrechen.
---------------------
b) Sekundärtoxizität: Nitrat kann durch Bakterien in Nitrit umgewandelt
werden. Dieser natürliche Vorgang kann sowohl im Mund, wie auch
im Magen-Darm-Trakt stattfinden. Das ist normalerweise nicht besorgniserregend.
Durch überhöhte Nitrataufnahme über Nahrung oder Trinkwasser kann
allerdings entsprechend mehr Nitrit gebildet werden. Nitrit kann
die Sauerstoffzufuhr über das Blut behindern, was zu Blausucht führen
kann. Speziell Säuglinge bis zum dritten Lebensmonat sind besonders
betroffen.
--------------------
c) Tertiärtoxizität: Nitrit und sekundäre Amine im Magen können
krebserregende Nitrosamine bilden. Nitrosamine gehören zu den krebserregendsten
Stoffen, die man kennt.
Die toxische Wirkung des Nitrats ist vor allem auf das daraus gebildete
Nitrit zurückzuführen, das hauptsächlich durch bakterielle Reaktionen
im Mund oder Darm gebildet wird. Nitrit ist in der Lage, den Blutfarbstoff
Hämoglobin zu so genannten Methämoglobin zu oxidieren, das Sauerstoff
so fest bindet, dass er nicht mehr an die Zellen abgegeben werden
kann. So kann kein Sauerstoff mehr transportiert werden und die
Säuglinge "ersticken innerlich", es kommt zur Cyanose, der so genannten
Blausucht. Nitrosamine gehören zu den stärksten Krebserregern. Die
direkte Aufnahme mit bestimmten Lebensmitteln, wie geräucherter
Wurst oder Käse, ist allerdings gering. Bedeutender ist die Bildung
von Nitrosaminen aus Nitrat bzw. Nitrit die im Körper stattfindet.
Nitrate-Reduktion im Trinkwasser durch Umkehrosmosefilter: Wässer die den aktuellen Grenzwert für NO3- in Trinkwasser überschreiten, werden von Wasserversorgern oft solange mit nitratärmerem Wasser vermischt, bis der Grenzwert eingehalten wird. In jüngster Zeit kommen erste Wasseraufbereitungsanlagen die mit Umkehrosmose-Filtern oder Nanofiltration ausgestattet sind zum Einsatz, um durch Teilentsalzung den Nitratwert im Trinkwasser abzusenken.

Nitrite
sind die toxischen Salze und Ester der Salpetrigen Säure HNO2.
Nitritionen werden im Boden, in Gewässern und in Kläranlagen von
Nitritbakterien (Nitrosomonas) durch Oxidation aus Ammoniumionen
unter Sauerstoffverbrauch gebildet. Nitrite sind das Zwischenprodukt
der Nitrifikation bei der vollständigen Oxidation des Stickstoffs
zu Nitrat und entstehen auch unter anaeroben Bedingungen durch bakterielle
Reduktion aus Nitrat-Ionen, der so genannten Nitratreduktase. Nitrite
sind auch für Fische (wobei dabei eine starke Abhängigkeit vom pH-Wert
des Wassers besteht, da nur die Salpetrige Säure durch die Kiemen
in den Körper gelangen kann) in größeren Mengen giftig und an der
Bildung der kanzerogenen Nitrosamine beteiligt.
|




